
Gesunder Knorpel dank Bio-Tinte
Wie bringt man Knorpel in beschädigten Gelenken zum Nachwachsen? Diese Frage stellt sich das von der Werner Siemens-Stiftung neu unterstützte Projekt TriggerINK am DWI – Leibniz-Institut für Interaktive Materialien in Aachen. Ein Laborbesuch zeigt: Es braucht neue Materialien, modernste Techniken – und Teamarbeit.
Die besten Tüftlerinnen und Forscher sind Eigenbrötler, heisst es zuweilen. Sie sitzen in ihren Kämmerchen und brüten über einem Problem, bis sie es mit einem Geistesblitz gelöst haben. Manche grossen Fragen unserer Zeit mögen auf diese Weise gelöst worden sein. Andere Forschungsvorhaben aber sind schlicht zu komplex, als dass jemand sie alleine meistern könnte.
Für ein solches Grossprojekt haben sich in Aachen vier Forschungsgruppen des DWI – Leibniz-Instituts für Interaktive Materialien zusammengetan. Ihr Projekt TriggerINK, das die Werner Siemens-Stiftung seit 2022 für einen Zeitraum von fünf Jahren mit insgesamt 10 Millionen Euro unterstützt, zielt darauf ab, eine visionäre Methode zur Knorpel-Regenerierung zu entwickeln.
Geleitet wird das Vorhaben von Laura De Laporte, Mitglied der wissenschaftlichen Leitung des DWI und Professorin für Advanced Materials and Biomedicine an der Rheinisch-Westfälischen Technischen Hochschule (RWTH) Aachen. Komplettiert wird das Team durch ihre RWTH-Kollegen Stefan Hecht, Wissenschaftlicher Direktor des DWI und Professor für Makromolekulare Chemie, Andreas Herrmann, stellvertretender Wissenschaftlicher Direktor des DWI und Professor für Makromolekulare Materialien und Systeme, sowie Matthias Wessling, Mitglied der wissenschaftlichen Leitung des DWI und Professor für Chemische Verfahrenstechnik. Darüber hinaus begleitet und berät ein Team externer Experten das Projekt.
TriggerINK zielt auf eines der häufigsten Gesundheitsprobleme unserer Zeit: Gelenkschmerzen. Die Gründe für Gelenkschmerzen sind vielfältig, doch besonders oft leiden Menschen an Knorpelverschleiss (Arthrose) oder Meniskusschäden im Knie. In Deutschland hat jede fünfte Person in ihrem Leben schon einmal eine Arthrose diagnostiziert bekommen – Tendenz steigend. Denn die Menschen werden älter, und die Zahl der Übergewichtigen steigt.

Verschiedene Knorpelschichten
Menisken und Knorpel übernehmen wichtige Aufgaben im Gelenk: Sie verteilen den durch Bewegung ausgeübten Druck, dämpfen Stösse ab und ermöglichen es den Knochen, mit geringer Reibung und hoher Geschwindigkeit aneinander entlangzugleiten. Abgenutztes oder beschädigtes Knorpelgewebe wächst nicht von selbst nach. Zwar gibt es Verfahren wie die Knorpeltransplantation und einige Substanzen, die dem Aufbau des Gewebes helfen sollen. Jedoch sind solche Eingriffe zum Teil sehr teuer oder nur bei wenigen Menschen anwendbar – und ihr Erfolg ist nicht garantiert.
Eine grosse Schwierigkeit heutiger Regenerationsmethoden sei es, die richtige Struktur des Knorpelgewebes zu erzeugen, sagt Laura De Laporte. Der Knorpel im Kniegelenk etwa besteht aus verschiedenen Zonen: Direkt über dem Knochen bildet er eine feste Schicht mit einer vertikalen Mikrostruktur, durch die nur ganz langsam neue Knochenstammzellen hindurchgelangen. Darüber folgt eine grosse mittlere Hauptschicht mit einer eher zufällig ausgerichteten Zellstruktur. Ganz aussen schliesst eine glatte Schicht das Gewebe ab – ihre Zellen und Zellbestandteile sind horizontal ausgerichtet. «Jedes Gewebe und jede Struktur in unserem Körper hat eine klar definierte Ausrichtung», sagt Laura De Laporte. «Deshalb ist es bei einer Geweberegeneration entscheidend, das Zellwachstum in die richtige Richtung zu lenken.»

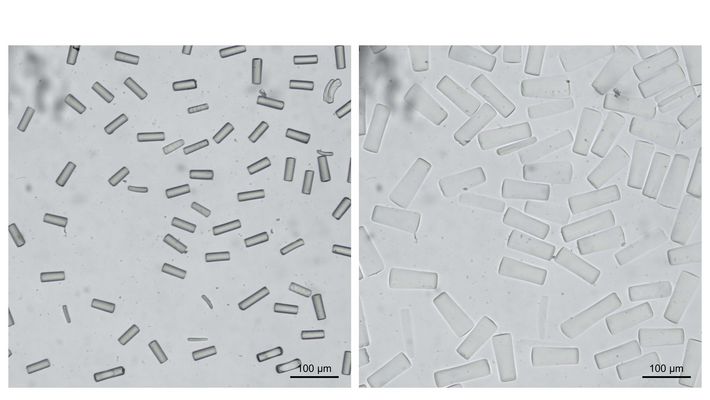
Produzieren und modellieren
Die Produktion der magnetischen Stäbchen in der Bio-Tinte wiederum ist das Metier der Forschungsgruppe von Matthias Wessling. Wie die Bio-Tinte selbst bestehen auch die Mikrostäbchen aus einem Hydrogel. Sie sind versetzt mit Nano-Magnetpartikeln. Hergestellt werden sie mit einer Maschine, welche die Verfahrenstechnikerinnen und Verfahrenstechniker um Wessling selbst entworfen haben. Das Polymer fliesst durch feine Schläuche und wird dann in bestimmten Regionen mittels UV-Licht ausgehärtet. Stop-Flow-Lithographie nennt sich dieses Verfahren.
Mithilfe von Schablonen lassen sich aus dem Hydrogel nicht nur Stäbchen, sondern alle möglichen Formen bilden. «Wir haben die Stop-Flow-Methode in den ersten Projektmonaten bereits deutlich weiterentwickeln können», sagt Matthias Wessling. Unter anderem steht bereits eine neue, verbesserte Produktionsmaschine in den Startlöchern.
Die produzierten Stäbchen und Teilchen werden laufend auf ihre Eigenschaften untersucht. Modellierungen sollen unter anderem zeigen, wie sie sich verhalten, wenn man sie in der Bio-Tinte mit einer Kanüle in den Körper bringt. Sammeln sie sich an einer Grenzschicht an? Wie beeinflussen sich Stäbchen und Tinte gegenseitig? Solche Fragen müssen geklärt sein, um keine unliebsamen Überraschungen zu erleben. Dazu ist eine intensive Zusammenarbeit zwischen den verschiedenen Arbeitsgruppen nötig.
Die Früchte dieser Arbeiten lassen sich in einem anderen Labor bestaunen. Ein Mitarbeiter von Laura De Laporte gibt mit magnetischen Stäbchen versetzte Bio-Tinte in eine Petrischale. Er hält zwei Magneten an die Schale – und durch das Mikroskop erkennt man, wie sich die Stäbchen alle in dieselbe Richtung gedreht haben. Dann wird die Tinte ausgehärtet. Darauf kommt eine neue Schicht, deren Nanostäbchen in eine andere Richtung ausgerichtet werden. So lassen sich die verschiedene Knorpelschichten simulieren, deren Zellschichten unterschiedliche Ausrichtungen haben.


Wachsen auf Kommando
Für den nächsten Schritt im TriggerINK-Gefüge sind Andreas Herrmann und seine Forschungsgruppe zuständig. Sie nutzen Ultraschall, um die Freisetzung biologischer Wirkstoffe von aussen zu steuern. Im Fall von TriggerINK werden dies Wachstumsfaktoren und Entzündungshemmer sein. Diese Moleküle werden mit Trägerpartikeln versehen, die sich durch mechanische Kräfte verändern lassen. Die Anwendung des Ultraschalls führt dazu, dass die Trägerpartikel die Wachstumsfaktoren oder Entzündungshemmer tief im Gewebe freigeben – genau zur gewünschten Zeit und am richtigen Ort.
«Ein Problem dieser Aktivierung war bislang, dass man hohe Ultraschall-Intensitäten benötigt hat», sagt Andreas Herrmann. Einer seiner Studenten demonstriert dies im Labor. Er gibt eine durchsichtige Flüssigkeit in ein Röhrchen und stellt es in ein kistenförmiges Hochleistungs-Ultraschallgerät. Durch den Schalldruck verfärbt sich die Flüssigkeit bläulich. Doch während des Vorgangs muss der Forscher entweder einen Ohrenschutz tragen oder den Raum verlassen.
Für die Praxis kommen solch hohe Schalldrücke deshalb nicht infrage. «Doch kürzlich ist uns ein Durchbruch gelungen», erzählt Andreas Herrmann. «Wir haben gezeigt, dass wir auch mit viel weniger starkem Ultraschall Enzyme im Körper anschalten können.» In kranken Mäusen aktivierten die Forschenden mit einem Handultraschall-Scanner Immunzellen und verkürzten auf diese Weise die Heilungsphase der Tiere.
Fehlt noch der letzte Bestandteil der zukünftigen knorpelheilenden Bio-Tinte: die schrumpfenden und anschwellenden Mikrogel-Teilchen, die mechanische Reize auf die Zellen ausüben. Diese Partikel werden im Labor von Laura De Laporte hergestellt – mithilfe einer speziellen Technik, bei der eine kontrollierte Emulsion entsteht. In winzigen Kanälen bildet die dickflüssige, wässrige Polymer-Lösung kleine Tropfen, wenn sie mit Öl zusammengebracht wird. Je nach Flüssigkeitseigenschaften, Kanalgrösse und Strömungsbedingungen ergeben sich unterschiedliche Tropfenformen. Die Tropfen werden im Kanal mit Licht beleuchtet und härten in der entsprechenden Form als Mikrogel aus. Ziel der Forschenden ist es, eine ganze Bibliothek solcher Mikrogel-Formen herzustellen und sie auf ihre Eigenschaften zu testen. «Welche Kräfte für unser Projekt am geeignetsten sein werden, wissen wir noch nicht», sagt Laura De Laporte.
Bewegung bringt Heilung
Die Mikrogele funktionieren wie winzig kleine Schwämme. In der Bio-Tinte sollen sie durch Infrarot-Lichtimpulse, die tief in das Gewebe eindringen, zum Kollabieren gebracht werden. Sie wringen sich selbst aus – und werden kleiner. Durch das Schrumpfen versetzen sie das umliegende Hydrogel und die wachsenden Gewebe in Bewegung, was den Heilungsprozess beschleunigt.
Noch liegt die Knorpelheilung durch das TriggerINK-System in weiter Ferne. Doch bereits beginnen die einzelnen Teilprojekte zusammenzuwachsen. Erste Experimente zeigen beispielsweise, dass die magnetischen Stäbchen in der Bio-Tinte tatsächlich die Richtung des Zellwachstums beeinflussen. Nachdem die Stäbchen in eine bestimmte Richtung ausgerichtet wurden, durften die Zellen für einige Tage weiterwachsen. Unter dem Mikroskop, das zeigt eine letzte Station auf dem Laborrundgang, lässt sich beobachten, wie das Wachstum der Zellen entlang der Stäbchen verläuft.
Das ambitionierte TriggerINK-Projekt ist also sehr gut angelaufen. Dazu trage auch bei, dass man mit Arne Lüken einen hervorragenden Projektkoordinator gefunden habe, sagt Laura De Laporte. Er hat unter anderem die Aufgabe, die einzelnen Forschungsgruppen oder Subgruppen je nach Fragestellung und Teilprojekt zusammenzubringen. Das gelinge sehr gut, sagt De Laporte. «Denn die Mitarbeitenden brennen für das Projekt. Es ergibt neue Kooperationen innerhalb des DWI, man lernt sich noch besser kennen. Das ist grossartig, auch für die Stimmung im ganzen Institut.»


Ein ausgeklügelter Plan
Um ein schnelles und gerichtetes Zellwachstum zu erreichen, nutzt TriggerINK eine breite Palette an ausgeklügelten, hochmodernen Verfahren. Folgende Schritte sind geplant, um das Knorpelwachstum anzuregen:
> Auf den gesäuberten Knorpel des Patienten druckt ein 3D-Drucker schichtweise ein neu entwickeltes Hydrogel. Dabei handelt es sich um eine gelatineartige Substanz, die zum grossen Teil aus Wasser, zu einem kleineren Teil aus einem biokompatiblen Polymer besteht. Diese «Bio-Tinte» ist äusserst porös. Sie bildet eine Art Stützgerüst, durch dessen Kanäle das körpereigene Knorpelgewebe nachwachsen kann.
> Das Hydrogel ist vollgepackt mit Partikeln, welche für das Zellwachstum auf die eine oder andere Art wichtig sind. So gibt es darin magnetische Stäbchen mit einem Durchmesser von zwei bis fünf und einer Länge von ungefähr 50 Mikrometern. Solange das Hydrogel-Gerüst noch nicht starr ist, lassen sie sich mithilfe eines niedrigen externen Magnetfeldes ausrichten. Sie dienen dazu, die Wachstumsrichtung der Knorpelzellen zu kontrollieren: Die Zellen spüren den Widerstand dieser Stäbchen und wachsen parallel zu deren Ausrichtung.
> Ins Hydrogel integriert werden auch Partikel, die Wachstumsfaktoren oder Entzündungshemmer enthalten. Der Clou: Mittels Ultraschall können die Forschenden die Partikel dazu anregen, diese Substanzen lokal zu bestimmten Zeitpunkten freizusetzen. So lässt sich beispielsweise kontrollieren, wann das Gewebewachstum angeregt werden soll.
> Eine letzte Zutat im Hydrogel sind Mikropartikel, die sich mittels eines Lichtsignals von aussen verändern lassen. Je nach Signal verändern die Partikel ihre Grösse. Dieses Schrumpfen und Anschwellen der Partikel versetzt die umliegenden Gewebezellen in Bewegung. Von solchen Bewegungen wird angenommen, dass sie den Heilungsprozess beschleunigen können.
> Wie viel Forschung und wie viel interdisziplinäre Zusammenarbeit es braucht, um diesen Plan in die Tat umzusetzen, zeigt ein Laborrundgang am DWI. Es fällt auf: Viele Komponenten des Grossprojekts TriggerINK sind schon nach nur einem Jahr auf einem sehr guten Weg. Eine Bio-Tinte beispielsweise hat die Forschungsgruppe von Laura De Laporte bereits konstruiert. «Wir wissen, dass Körperzellen dieses Hydrogel lieben und gut darin wachsen», sagt sie. Im Körper der Patientin oder des Patienten müssen sich die Polymerstäbchen des Hydrogels miteinander zu einer festen, gitterähnlichen Struktur verbinden. Allerdings darf die Verkettung erst dann geschehen, wenn die magnetischen Stäbchen im Gel richtig ausgerichtet sind. Es braucht deshalb eine Möglichkeit, um den Verkettungsprozess von aussen in Gang zu setzen.
An dieser Steuerung arbeitet die Forschungsgruppe von Stefan Hecht. Eine Idee ist es, mit chemischen Methoden ganz bestimmte Moleküle als eine Art Schutzkappe an die Enden der einzelnen Hydrogel-Polymerstäbchen zu heften, damit sie sich nicht verketten, bis die Magnetstäbchen korrekt ausgerichtet sind. Dann lassen sich die Schutzkappen-Moleküle mit einem Lichtpuls von den Hydrogel-Enden lösen, worauf die Polymere sich miteinander verbinden. Ein Problem dieses Vorgehens: Die gelösten Schutzkappen-Moleküle verbleiben als Nebenprodukte im Körper. «Es ist schwierig vorauszusagen, ob und wie sie mit anderen Stoffen reagieren», sagt Stefan Hecht.
Er und seine Mitarbeitenden forschen deshalb an einer innovativen Alternative: sogenannten molekularen Photoschaltern. Dafür synthetisieren sie ganz bestimmte Moleküle, die ihre Form und ihre Eigenschaften verändern, wenn sie mit Licht bestrahlt werden. Das hat den Vorteil, dass es keine zusätzlichen Schutzkappen-Moleküle braucht. Die Synthese solcher Photoschalter-Moleküle ist komplex. Aber Stefan Hecht sieht sein Team auf einem guten Weg. «Das System funktioniert – und die Synthesen zu verbessern und zu beschleunigen ist die Kernkompetenz von uns Chemikerinnen und Chemikern», sagt er.



